Dosages colorimétriques - Spécialité
Dosage par étalonnage
Exercice 1 : Applications de la loi de Beer-Lambert
Le coefficient d'absorption molaire du Diiode est \( \varepsilon = 9,00 \times 10^{2} L\mathord{\cdot}cm^{-1}\mathord{\cdot}mol^{-1} \) à \( 520 nm \).
Dans une cuve de longueur \( l_1 = 1,50 \times 10^{-2} m \), on place une solution de Diiode de concentration \( 4,10 \times 10^{-8} mol\mathord{\cdot}mL^{-1} \).
On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
On mesure une absorbance \( A_4 = 3,09 \times 10^{-1} \) à \( 520 nm \) avec la cuve de longueur \( l_1 \).
Déterminer la concentration \( c_4 \) de la solution.On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
Exercice 2 : Spectrophotomètre et longueur d’onde d’absorption
On dispose d’une solution de couleur Jaune-vert dont on veut déterminer
la concentration par étalonnage colorimétrique.
Pour cela, on utilise un spectrophotomètre qui doit être réglé sur la longueur d’onde la mieux adaptée
à un étalonnage de précision.
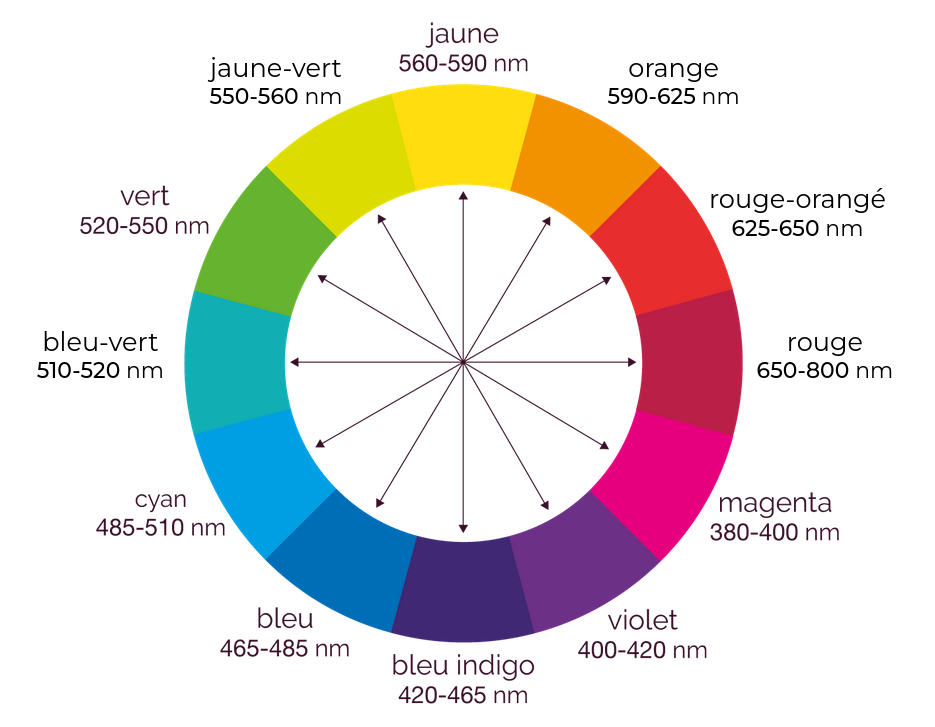
Pour choisir précisément la longueur d’onde sur laquelle régler le spectrophotomètre, on relève différentes
valeurs d’absorbance pour différentes longueurs d’ondes.
Les valeurs mesurées sont présentées dans le tableau ci-dessous.
| \( \lambda \) en nm | \( 400 \) | \( 420 \) | \( 450 \) | \( 475 \) | \( 500 \) | \( 515 \) | \( 535 \) | \( 555 \) | \( 575 \) | \( 615 \) | \( 640 \) | \( 725 \) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| \( A \) | \( 0\mbox{,}12 \) | \( 2\mbox{,}16 \) | \( 0\mbox{,}58 \) | \( 0\mbox{,}91 \) | \( 1\mbox{,}62 \) | \( 1\mbox{,}64 \) | \( 0\mbox{,}59 \) | \( 1\mbox{,}6 \) | \( 0\mbox{,}9 \) | \( 1\mbox{,}09 \) | \( 1\mbox{,}52 \) | \( 2\mbox{,}06 \) |
Exercice 3 : Absorbance et concentration en quantité de matière (concentration molaire)
Un spectrophotomètre, réglé sur la longueur d'onde \( 560 nm \), a permis de mesurer l'absorbance
de quatre échantillons d'une solution \( S \) de compositions identiques et de concentrations différentes.
Les valeurs des concentrations \( C \) et des absorbances \( A \) des solutions sont indiquées dans le tableau
ci-dessous.
| Solution | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Concentration \( C \) | \( 40 mmol\mathord{\cdot}L^{-1} \) | \( 50 mmol\mathord{\cdot}L^{-1} \) | \( 60 mmol\mathord{\cdot}L^{-1} \) | \( 80 mmol\mathord{\cdot}L^{-1} \) |
| Absorbance \( A \) | 1,63 | 1,99 | 2,26 | 3,06 |
On donnera un résultat avec 2 chiffres significatifs et suivi de l'unité qui convient.
Exercice 4 : Applications de la loi de Beer-Lambert
Le coefficient d'absorption molaire du Bleu patenté V est \( \varepsilon = 9,85 \times 10^{4} L\mathord{\cdot}cm^{-1}\mathord{\cdot}mol^{-1} \) à \( 630 nm \).
Dans une cuve de longueur \( l_1 = 2,80 \times 10^{1} mm \), on place une solution de Bleu patenté V de concentration \( 3,90 \times 10^{-8} mol\mathord{\cdot}mL^{-1} \).
On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
On mesure une absorbance \( A_4 = 9,05 \times 10^{1} \) à \( 630 nm \) avec la cuve de longueur \( l_1 \).
Déterminer la concentration \( c_4 \) de la solution.On donnera la réponse avec \( 3 \) chiffres significatifs et suivie de l'unité qui convient.
Exercice 5 : Spectrophotomètre et longueur d’onde d’absorption
On dispose d’une solution de couleur Jaune dont on veut déterminer
la concentration par étalonnage colorimétrique.
Pour cela, on utilise un spectrophotomètre qui doit être réglé sur la longueur d’onde la mieux adaptée
à un étalonnage de précision.

Pour choisir précisément la longueur d’onde sur laquelle régler le spectrophotomètre, on relève différentes
valeurs d’absorbance pour différentes longueurs d’ondes.
Les valeurs mesurées sont présentées dans le tableau ci-dessous.
| \( \lambda \) en nm | \( 400 \) | \( 420 \) | \( 450 \) | \( 475 \) | \( 500 \) | \( 515 \) | \( 535 \) | \( 555 \) | \( 575 \) | \( 615 \) | \( 640 \) | \( 725 \) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| \( A \) | \( 0\mbox{,}05 \) | \( 0\mbox{,}79 \) | \( 1\mbox{,}87 \) | \( 1\mbox{,}54 \) | \( 0\mbox{,}22 \) | \( 0\mbox{,}14 \) | \( 1\mbox{,}84 \) | \( 1\mbox{,}17 \) | \( 0\mbox{,}45 \) | \( 0\mbox{,}72 \) | \( 1\mbox{,}39 \) | \( 0\mbox{,}28 \) |